RESUMO
INTRODUÇÃO: A leucinose ou doença do xarope de bordo (DXB) é um erro inato do metabolismo causado pela deficiência na atividade do complexo enzimático alfa-cetoácido-desidrogenase, que leva ao acúmulo de aminoácidos essenciais de cadeia ramificada (leucina, valina e isoleucina), sendo a leucina particularmente tóxica para o sistema nervoso central (SNC).
OBJETIVOS: Relatar um caso de doença do xarope de bordo em um recém-nascido (RN) com 10 dias de vida, filhos de pais consanguíneos, diagnosticado tardiamente, com elevados níveis de leucina, apresentando prognóstico desfavorável.
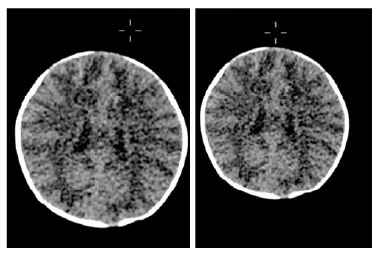
COMENTÁRIOS: A DXB é uma doença rara, de origem autossômica recessiva, que ocorre devido ao acúmulo de aminoácidos essenciais de cadeia ramificada nos tecidos, sendo eles a leucina, a valina e a isoleucina. O acúmulo de aminoácidos afeta, principalmente, o SNC. Estudos demonstraram que a concentração elevada de leucina diminui a concentração sérica de sódio e aumenta a água intracelular, gerando edema cerebral. O dano neurológico irá depender do grau e do tempo de exposição dos tecidos aos metabólitos. Apesar do desfecho desfavorável do caso apresentado, o prognóstico do DXB pode ser modificado com um controle rigoroso da dieta e manejo precoce e agressivo de crise metabólica.
Palavras-chave: Doença da urina de xarope de bordo, Leucina, Erros inatos do metabolismo dos aminoácidos.